本期专家
章振林
上海交通大学附属第六人民医院
骨质疏松和骨病科&骨代谢病和遗传研究室
(上海200233)
目前抗骨质疏松药物按作用机制可以分为抑制骨吸收和增加骨形成两类药物,抑制骨吸收代表药物是二膦酸盐类,而促进骨形成代表药物为甲状旁腺素。最近有一些新型抗骨质疏松已经研发成功,有些已经或者即将上市,我们充满期待。这些药物的研发成功正是源于对罕见骨病致病基因的发现及对机制的阐明。本文主要介绍少见骨病致病基因及其相关信号通路如:OPG/RANKL/RANK、WNT Wnt/β-catenin和组织蛋白酶K信号通路,及其相关的抗骨质疏松新型药物。
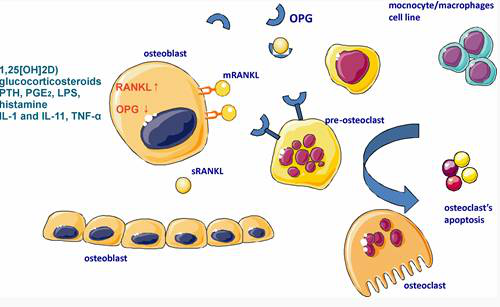
一、OPG/RANKL/RANK信号通路
该通路不但涉及骨骼系统,而且对免疫、血液系统等均有重要作用。核因子κB(nuclear factor kappa-B, NF-κB)受体活化素配体(receptor activator of nuclear factor kappa-B ligand , RANKL)与NF-κB受体活化因子(receptor activator of nuclear factor kappa-B,RANK)结合后激活NF-κB,促进破骨细胞的生成、分化和成熟,而骨保护素(osteoprotegerin, OPG)可与RANKL结合,阻止RANK活化,抑制破骨细胞活性。如下一些少见或罕见遗传性骨病致病基因均涉及该通路。
1骨保护素(OPG)基因突变
青少年性畸形性骨炎(juvenile Paget disease of bone)是常染色体隐性遗传病[1],不同于经典型畸形性骨炎,前者在出生后或婴幼儿时期即起病,由于破骨细胞功能增强,骨吸收显著增加,骨溶解和疏松、骨骼弯曲畸形,常伴骨折,血ALP显著增高。
2RANK基因突变
表现为多骨骼受累,以骨溶解为特征。与其他类型畸形性骨炎区别还在于双手指关节膨大和下颌骨膨大[2],我们2008年[3]报告一个汉族家系鉴定到RANK基因第一外显子27bp重复突变。
3RANKL基因突变
RANKL基因纯合突变导致骨硬化症伴低γ球蛋白血症,属于常染色体隐型遗传性骨硬化症,由Guerrini等[4]报告是由于破骨细胞功能低下,骨吸收下降,显然与上述OPG或RANK基因突变导致破骨细胞功能增强的机制正好相反。
正是基于对上述罕见遗传性骨病和致病基因之认识,研发了RANKL单克隆抗体,即Denosumab(地诺沙巴) 。其与RANKL结合,阻止了RANK和RANKL结合,导致破骨细胞功能下降,抑制骨吸收,从而达到治疗骨质疏松的目的。
已经完成的3年随机对照试验(FREEDOM)结果显示[5]:明显降低绝经后骨质疏松患者新发影像学椎体骨折和髋部骨折发生风险,随后的FREEDOM延长试验对4550例绝经后妇女使用Denosumab治疗5年显示:骨转换指标维持在低水平、骨密度显著增加(腰椎和全髋部骨密度分别增加14%和7%)以及骨折风险降低[6];在国内,由本人牵头联合十多家三甲医院已经完成了安进(Amgen)公司研发的Denosumab的III期临床试验。
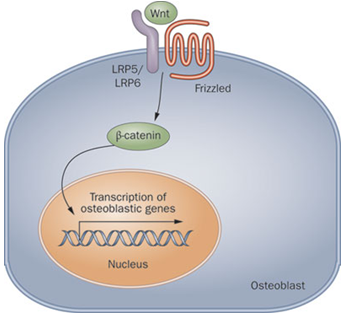
二、Wnt/β-catenin信号通路
WnT信号系统对骨代谢具有重要作用的认识,源于两类遗传性骨代谢病的分子机制之阐明,即2001年Cell杂志发表了[7]骨质疏松伴假性神经胶质瘤综合征(osteoporosis pseudoglioma syndrome),鉴定到低密度脂蛋白相关蛋白5(LRP5)纯合突变,为功能丢失之突变;随后,两个独立研究均发现高骨密度综合征[8, 9],也称为常染色体显性遗传性骨硬化症1型,致病基因也是LRP5,为功能增强性杂合突变,我们也曾报告1个汉族患病家系[10]。LRP5对Wnt/β-catenin信号通路具负调节作用,不同突变呈现骨形成下降或增加的表现。至此,确立了Wnt/β-catenin通路对骨代谢重要作用地位。2001年同时还发现硬化性骨病(bone dysplasia sclerosteosis)和Van Buchem病致病基因为硬骨素(SOST)基因[11, 12],该基因编码蛋白骨硬化素(Sclerostin) 通过对Wnt/β-catenin信号通路的负调节作用,降低骨形成,而功能丢失性突变,促进骨形成显著增加,导致骨密度显著增加,而且骨折风险并没有增加。
正是基于上述疾病分子机制的阐明以及对骨硬化素对骨形成作用的深入理解,最近国外大制药公司研发了血清骨硬化素单克隆抗体(Romosozumab)。2014年NEJM报告了[13]419名55-85岁低骨量(腰椎或股骨颈或全髋BMD T值<-2.0SD,而>-3.5SD)的绝经后妇女,随机分8组 ,接受不同剂量Romosozumab、阿仑膦酸钠、特立帕肽和安慰剂治疗1年。结果显示所有Romosozumab组均显著增加各部位骨密度,其中每3个月皮下注射210mg组增加腰椎BMD为11.3%,同时没有发现存在严重不良反应。该药物预计明年在中国开展III期临床试验。
三、组织蛋白酶K通路
组织蛋白酶K(cathepsin K, CTSK)对骨代谢的影响源自致密性成骨不全(pycnodysostosis),为常染色体隐性遗传病,表现头颅畸形(包括宽颅缝)、肢端骨质溶解,以及全身性骨骼发生均匀性致密性骨硬化,可以伴有锁骨发育不全,容易发生骨折。Maroteaux 和Lamy于1962年首次报道该病,1996年Gelb等[14]鉴定到致病基因是CTSK,存在无义突变、错义突变等,以致其编码蛋白功能丢失。我们于2013年对1例非近亲婚配男性先证者鉴定到CTSK基因R122Q 纯合突变[15]。CTSK是破骨细胞中表达量最高、溶骨活性最强的一种半胱氨酸蛋白酶,因此,抑制破骨细胞内的CTSK,可以降低骨吸收,以增加骨量。
为此,美国默克公司(即默沙东公司)等几家制药企业相继研发了选择性CTSK拮抗剂, 分别为Odanacatib、Relacatib和Balicatib。一项为期5年Odanacatib(ODN)对绝经后妇女骨量减少或骨质疏松的临床试验显示[16]:接受5年ODN10-50mg/周的受试者,腰椎和髋部BMD持续上升。13例接受ODN 50mg 连续5年的受试者,平均腰椎BMD变化百分比(95% CI) 为11.9% (7.2% - 16.5%) ,在连续接受ODN的受试者中(10–50 mg, 26–29例), 在第五年与基线相比,骨吸收指标:尿NTX/肌酐比值和CTX的下降百分比的几何均数达55%左右,而骨形成指标包括骨源性碱性磷酸酶(BSAP)和 P1NP则接近基线水平,无明显变化。主要不良反应是治疗后3年发现处理组发生尿路感染显著高于安慰剂组,至于特别关注的硬皮病不良反应与安慰剂组没有差异。从以上临床试验结果我们可以结论:选择性CTSK拮抗剂具有显著增加骨量、降低骨吸收之疗效,总体耐受性良好。该药已经在中国完成全球多中心III期临床研究。
四、展望与挑战
以上阐述的OPG/RANKL/RANK、Wnt/β-catenin和CTSK信号通路中研发了抑制骨吸收或者促进骨形成的抗骨质疏松药物,正是基于罕见或少见的遗传性骨病的致病基因之发现,值得我们国内学者关注和学习,在临床需关注罕见疾病家系的收集及分子机制的研究,不但可以明确诊断罕见疾病,而且对常见疾病治疗药物的研发具有重大意义。
就目前的临床研究结果来言,上述信号通路研发的抗骨质疏松新型药物均具有良好的疗效,部分药物已经在中国开展临床试验。当然,这些药物的远期疗效和潜在不良反应尚待观察,而且确切的作用机制以及与其他抗骨质疏松药物联合应用之疗效均需要进一步证实。
专家简介
章振林

上海交通大学附属第六人民医院骨质疏松和骨病科主任,骨代谢病和遗传研究室主任,医学博士、教授、主任医师、博士研究生导师,兼任中华医学会骨质疏松和骨矿盐疾病分会候任主任委员、上海医学会骨质疏松专科分会主任委员。
主要诊治代谢病骨病,研究方向为代谢病骨病遗传机制,以第一完成人获得国家自然科学基金6项,发表SCI收录论文60多篇。
参考文献:
1. Whyte MP, Obrecht SE, Finnegan PM, Jones JL, Podgornik MN, McAlister WH, Mumm S. Osteoprotegerin deficiency and juvenile Paget's disease. N Engl J Med. 2002; 347(3):175-84.
2. Nakatsuka K, Nishizawa Y, Ralston SH. Phenotypic characterization of early onset Paget's disease of bone caused by a 27-bp duplication in the TNFRSF11A gene. J Bone Miner Res. 2003; 18(8):1381-5.
3. Ke YH, Yue H, He JW, Liu YJ, Zhang ZL. Early onset Paget's disease of bone caused by a novel mutation (78dup27) of the TNFRSF11A gene in a Chinese family. Acta Pharmacol Sin. 2009; 30(8):1204-10.
4. Guerrini MM, Sobacchi C, Cassani B, Abinun M, Kilic SS, Pangrazio A, Moratto D, Mazzolari E, Clayton-Smith J, Orchard P, Coxon FP, Helfrich MH, Crockett JC, Mellis D, Vellodi A, Tezcan I, Notarangelo LD, Rogers MJ, Vezzoni P, Villa A, Frattini A. Human osteoclast-poor osteopetrosis with hypogammaglobulinemia due to TNFRSF11A (RANK) mutations. Am J Hum Genet. 2008; 83(1):64-76.
5. Cummings SR,San Martin J, McClung MR, Siris ES, Eastell R, Reid IR, Delmas P, Zoog HB, Austin M, Wang A, Kutilek S, Adami S, Zanchetta J, Libanati C, Siddhanti S, Christiansen C. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med. 2009; 361(8):756-65.
6. Papapoulos S, Chapurlat R, Libanati C, Brandi ML, Brown JP, Czerwiński E, Krieg MA, Man Z, Mellström D, Radominski SC, Reginster JY, Resch H, Román Ivorra JA, Roux C, Vittinghoff E, Austin M, Daizadeh N, Bradley MN, Grauer A, Cummings SR, Bone HG. Five years of denosumab exposure in women with postmenopausal osteoporosis: results from the first two years of the FREEDOM extension. J Bone Miner Res. 2012; 27(3):694-701.
7. Gong Y, Slee RB, Fukai N, Rawadi G, Roman-Roman S, Reginato AM, Wang H, Cundy T, Glorieux FH, Lev D, Zacharin M, Oexle K, Marcelino J, Suwairi W,Heeger S, Sabatakos G, Apte S, Adkins WN, Allgrove J, Arslan-Kirchner M, Batch JA, Beighton P, Black GC, Boles RG, Boon LM, Borrone C, Brunner HG, Carle GF, Dallapiccola B, De Paepe A, Floege B, Halfhide ML, Hall B, Hennekam RC, Hirose T, Jans A, Jüppner H, Kim CA, Keppler-Noreuil K, Kohlschuetter A,LaCombe D, Lambert M, Lemyre E, Letteboer T, Peltonen L, Ramesar RS, Romanengo M, Somer H, Steichen-Gersdorf E, Steinmann B, Sullivan B, Superti-Furga A, Swoboda W, van den Boogaard MJ, Van Hul W, Vikkula M, Votruba M, Zabel B, Garcia T, Baron R, Olsen BR, Warman ML. LDL receptor-related protein 5 (LRP5) affects bone accrual and eye development. Cell 2001; 107(4):513-23.
8. Boyden LM, Mao J, Belsky J, Mitzner L, Farhi A, Mitnick MA, Wu D, Insogna K, Lifton RP. High bone density due to a mutation in LDL-receptor-related protein 5. N Engl J Med. 2002; 346(20):1513-21.
9. Van Wesenbeeck L, Cleiren E, Gram J, Beals RK, Bénichou O, Scopelliti D, Key L, Renton T, Bartels C, Gong Y, Warman ML, De Vernejoul MC, Bollerslev J, Van Hul W. Six novel missense mutations in the LDL receptor-related protein 5 (LRP5) gene in different conditions with an increased bone density. Am J Hum Genet. 2003; 72(3):763-71.
10. Wang C, Zhang BH, Zhang H, He JW, Hu YQ, Li M, Yue H, Hu WW, Gu JM, Liu YJ, Fu WZ, ZhangZL. The A242T mutation in the low-density lipoprotein receptor-related protein 5 gene in one Chinese family with osteosclerosis. Intern Med. 2013; 52(2):187-92.
11. Balemans W, Ebeling M, Patel N, Van Hul E, Olson P, Dioszegi M, Lacza C, Wuyts W, Van Den Ende J, Willems P, Paes-Alves AF, Hill S, Bueno M, Ramos FJ,Tacconi P, Dikkers FG, Stratakis C, Lindpaintner K, Vickery B, Foernzler D, Van Hul W. Increased bone density in sclerosteosis is due to the deficiency of a novel secreted protein (SOST). Hum Mol Genet. 2001; 10(5):537-43.
12. Brunkow ME, Gardner JC, Van Ness J, Paeper BW, Kovacevich BR, Proll S, Skonier JE, Zhao L, Sabo PJ, Fu Y, Alisch RS, Gillett L, Colbert T, Tacconi P, Galas D, Hamersma H, Beighton P, Mulligan J. Bone dysplasia sclerosteosis results from loss of the SOST gene product, a novel cystine knot-containing protein. Am J Hum Genet. 200; 68(3):577-89.
13. McClung MR, Grauer A, Boonen S, Bolognese MA, Brown JP, Diez-Perez A, Langdahl BL, Reginster JY, Zanchetta JR, Wasserman SM, Katz L, Maddox J, Yang YC, Libanati C, Bone HG. Romosozumab in postmenopausal women with low bone mineral density. Engl J Med. 2014; 370(5):412-20.
14. Gelb BD, Shi GP, Chapman HA, Desnick RJ. Pycnodysostosis, a lysosomal disease caused by cathepsin K deficiency. Science. 1996; 273(5279):1236-8.
15. Zheng H, Zhang Z, He JW, Fu WZ, Zhang ZL. A novel mutation (R122Q) in the cathepsin K gene in a Chinese child with Pyknodysostosis. Gene. 2013 25; 521(1):176-9.
16. Langdahl B, Binkley N, Bone H, Gilchrist N, Resch H, Rodriguez Portales J, Denker A, Lombardi A, Le Bailly De Tilleghem C, Dasilva C, Rosenberg E, Leung A. Odanacatib in the treatment of postmenopausal women with low bone mineral density: five years of continued therapy in a phase 2 study. J Bone Miner Res. 2012; 27(11):2251-8.